
Content
Els protons, els neutrons i els electrons són les tres partícules principals que formen un àtom. Com indiquen els seus noms, els primers tenen una càrrega positiva, els segons no tenen cap càrrega (són neutres) i el tercer té una càrrega negativa. Els electrons tenen molt poca massa, mentre que els protons i els neutrons tenen massa gairebé idèntica. Podeu trobar el nombre de cadascun d’ells en un àtom només utilitzant la informació de la taula periòdica.
Passos
Part 1 de 2: càlcul de protons, electrons i neutrons
Obteniu una taula periòdica. És una imatge que organitza els elements per estructura atòmica. Es classifica per colors i dóna a cada element una abreviatura única d’una, dues o tres lletres. Una altra informació inclou la massa atòmica i el nombre.
- Podeu trobar una taula periòdica en línia o en un llibre de química.
Cerqueu el vostre element a la taula periòdica. Organitza els elements per nombre atòmic i els separa en tres grups principals: metalls, no metalls i metaloides (semimetalls). Altres agrupacions inclouen metalls alcalins, halògens i gasos nobles.- L’ús del grup (les columnes) o del punt (les files) pot fer que l’element sigui més fàcil de trobar a la taula.
- També podeu cercar el símbol de l'element si no coneixeu cap altra propietat.
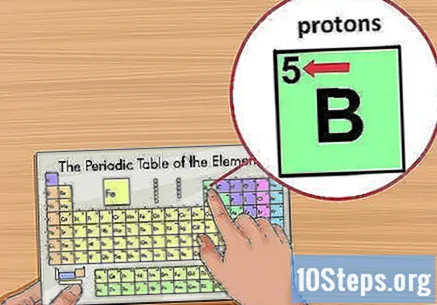
Localitza el nombre atòmic. Es troba a sobre del símbol de l'element, a l'extrem superior esquerre del quadrat. El nombre atòmic us indicarà quants protons formen un únic àtom d’aquest element.- Per exemple, el bor (B) té un nombre atòmic 5 i, per tant, cinc protons.
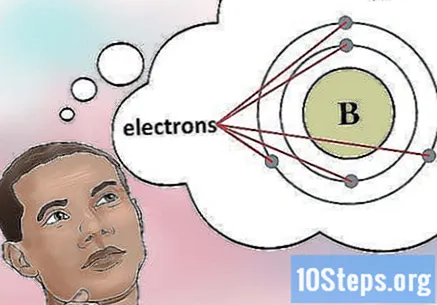
Determineu el nombre d’electrons. Els protons són partícules del nucli d’un àtom que tenen una càrrega positiva. Els electrons són partícules carregades negativament. Per tant, un element neutre tindrà el mateix nombre de protons i electrons.- Per exemple, el bor (B) té un nombre atòmic 5 i, per tant, cinc protons i cinc electrons.
- No obstant això, si l'element inclou un ió positiu o negatiu, els protons i els electrons no seran els mateixos. Els haureu de calcular. El número d'ions apareixerà com a petit superíndex després de l'element.
Busqueu la massa atòmica. Per trobar el nombre de neutrons, primer haureu de trobar la massa atòmica. Aquest valor és la massa mitjana dels àtoms d'un element i es pot trobar a sota del símbol de l'element.
- Arrodoneix la massa atòmica al següent nombre enter. Per exemple, la massa atòmica del bor és 10.811, però podeu arrodonir-la fins a 11.
Restar el nombre atòmic de la massa atòmica. Per trobar el nombre de neutrons, cal restar el nombre atòmic de la massa. Recordeu que el nombre atòmic és igual al dels protons, que ja s’ha identificat.
- Per al nostre exemple de bor, 11 (massa atòmica) - 5 (nombre atòmic) = 6 neutrons
Part 2 de 2: Càlcul d’electrons amb ions presents
Identifiqueu el nombre d’ions. Apareixerà com un petit valor de superíndex després de l'element. Un ió és un àtom amb una càrrega positiva o negativa a causa de l’addició o eliminació d’electrons. En un ió, tot i que el nombre de protons continua sent el mateix, el nombre d’electrons canvia.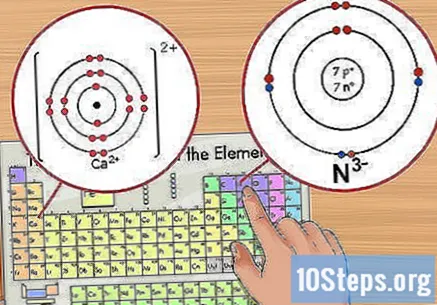
- Com que l’electró té una càrrega negativa, quan s’elimina, l’ió esdevé positiu. A mesura que s’afegeixen més electrons, l’ió es torna negatiu.
- Per exemple, N té una càrrega de -3, mentre que Ca té una càrrega de +2.
- Recordeu que no cal fer aquest càlcul si no hi ha un número de superíndex després de l’element.
Resteu la càrrega del nombre atòmic. Quan un ió té una càrrega positiva, l’àtom ha perdut electrons. Per calcular la quantitat restant, resteu la quantitat de recàrrec addicional del nombre atòmic. En el cas d’un ió positiu, hi ha més protons que electrons.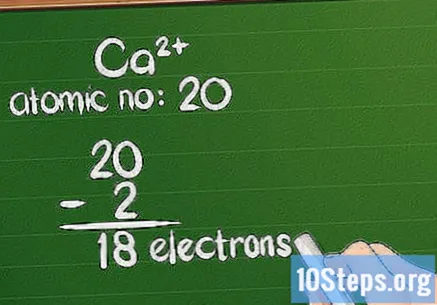
- Per exemple, el Ca té una càrrega de +2, de manera que ha perdut 2 electrons del seu estat natural. El nombre atòmic del calci és 20, de manera que l’ió té 18 electrons.
Afegiu la càrrega al nombre atòmic per als ions negatius. Quan un ió té una càrrega negativa, l'àtom ha guanyat electrons. Per calcular el nombre total d’ells, només cal afegir la quantitat de recàrrec addicional al nombre atòmic. En el cas d’un ió negatiu, hi ha menys protons que electrons.
- Per exemple, N té una càrrega de -3, de manera que va guanyar tres electrons en comparació amb el seu estat neutre. El nombre atòmic de nitrogen és de 7, de manera que aquest ió té 10 electrons.


