Autora:
Mike Robinson
Data De La Creació:
7 Setembre 2021
Data D’Actualització:
11 Ser Possible 2024
Content
El nombre atòmic correspon al nombre de protons del nucli d’un sol àtom d’un element. Aquest valor no canvia; per tant, podeu utilitzar-lo per descobrir altres característiques de l’isòtop, com ara el nombre de neutrons.
Passos
Part 1 de 2: Trobar el número atòmic
Cerqueu una còpia de la taula periòdica. Feu clic aquí si no en teniu cap disponible. Cada element té el seu propi nombre atòmic; per tant, no hi ha dreceres per aprendre el contingut. Utilitzeu una còpia de la taula o intenteu memoritzar-la.
- La majoria de llibres de química tenen la taula impresa a la contraportada.

Cerqueu l'element que esteu estudiant a la taula. La majoria de taules inclouen el nom complet dels elements, així com els seus símbols (Hg per al mercuri, per exemple). Si no trobeu el que busqueu, aneu a la xarxa i feu una cerca amb els termes "símbol químic" i el nom de l'element.
Trobeu el nombre atòmic de l’element. Normalment es troba a l’angle superior esquerre o dret de la casa de l’element, però també pot aparèixer en altres llocs. A més, sempre és un valor enter.- Si el nombre inclou un punt decimal, probablement indica la massa atòmica.
Confirmeu la informació segons els elements propers. La taula periòdica s’organitza segons l’ordre dels nombres atòmics. Si el vostre número d'isòtops és "33", per exemple, l'element de l'esquerra serà "32" i el de la dreta serà "34". En aquest cas, és perquè es mira el nombre atòmic.
- Hi ha un salt entre els elements "56" (bari) i "88" (ràdio). Els isòtops que corresponen a aquest rang es troben a les dues files de sota de la taula. Només se separen així perquè la taula no sigui massa gran.

Comprendre què significa el nombre atòmic. El nombre atòmic té una definició senzilla: la quantitat de protons en un àtom de l'element. Aquesta quantitat de protons, al seu torn, determina la càrrega elèctrica total del nucli, que, en conseqüència, determina quants electrons pot carregar l'àtom. Atès que els electrons són responsables de gairebé totes les interaccions químiques, el nombre atòmic afecta indirectament les propietats físiques i químiques de l’element.- Dit d’una altra manera, cada àtom amb vuit protons correspon a un àtom d’oxigen. Dos àtoms d’oxigen poden tenir un nombre diferent de neutrons o (si un és un ió) o electrons, però sempre tindran vuit protons cadascun.
Part 2 de 2: Descobrir informació més important
Determineu el pes atòmic. Normalment passa amb el nom de l'element de la taula periòdica i té dos o tres decimals. El pes atòmic correspon a la massa mitjana dels àtoms d’un element, que representa com es troba a la natura. Es mesura en "unitats de massa atòmica" ("u" o "u.m.a").
- Molts científics prefereixen utilitzar el terme "massa atòmica" en lloc de pes.
Comprendre la massa atòmica. El concepte de massa atòmica és molt similar al del pes. La diferència és que el pes indica la massa mitjana de qualsevol àtom de l’element, no un àtom específic. Per exemple: un gram de ferro conté diversos àtoms amb masses variables; el pes indica la seva "massa relativa". Si estudieu un sol àtom de l’element, només haureu de conèixer la seva massa específica.
- En general, només els problemes de química que impliquen àtoms informen del nombre de massa atòmica. Només cal que entengueu el concepte per no deixar-vos desconcertar quan veieu un valor diferent.
Arrodoneix el nombre de la massa. El nombre de massa correspon a la quantitat total de protons i neutrons en un àtom de l'element. No és difícil calcular-lo: només cal agafar la massa atòmica impresa a la taula periòdica i arrodonir-la al valor sencer més proper.
- Això funciona perquè les quantitats de neutrons i protons són molt properes a 1 u.m.a., mentre que la d’electrons és molt propera a zero. La massa atòmica implica càlculs exactes per determinar el valor decimal, però les úniques dades que importen són els nombres enters, que indiquen quants protons i neutrons hi ha.
- Recordeu que si utilitzeu massa atòmica, us enganyareu amb el pes d’un àtom específic en un element. Una mostra de brom, per exemple, té una massa atòmica de 79 o 81.
Calculeu el nombre de neutrons. Ara ja sabeu que el nombre atòmic és igual al nombre de protons i que el nombre de massa és igual a la suma del nombre de protons i neutrons. Per determinar la quantitat de neutrons d’un element, només cal restar el nombre atòmic d’aquesta massa total. Alguns exemples:
- Un àtom d'heli (He) té un nombre de massa de 4 i un nombre atòmic de 2. Per tant, 4 - 2 = 2 neutrons.
- Una mostra de plata (Ag) té un nombre de masses mitjà de 108 (segons la taula periòdica) i un nombre atòmic de 47. De mitjana, cada àtom de la mostra té 108 - 47 = 61 neutrons.
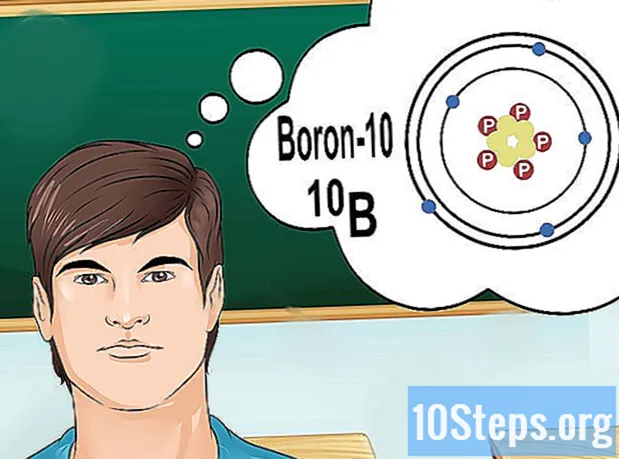
Comprendre els isòtops. Un isòtop és una forma específica d’un element que conté una sèrie de neutrons. Si el problema que voleu resoldre comporta alguna cosa com "bor-10" o "B", és perquè esteu parlant dels elements de bor amb un nombre de massa de 10. Utilitzeu aquest valor, no els valors "normals" de bor.
- El nombre atòmic d’isòtops no canvia mai. Tots els isòtops d’un element tenen el mateix nombre de protons.
Consells
- El pes atòmic d’alguns elements més pesats apareix entre parèntesis o claudàtors. Això significa que aquest pes és la massa exacta de l’isòtop més estable, no una mitjana de diversos isòtops. Finalment, això no afecta el nombre atòmic de l’element.