Content
Les molècules són conjunts d’àtoms que s’uneixen. En alguns casos, aquestes connexions fan que les càrregues elèctriques es distribueixin de manera desigual a través de la molècula, creant dos pols, un positiu i un altre negatiu. Quan això succeeix, la molècula s’anomena polar. Podeu esbrinar si una molècula és polar o no polar analitzant els enllaços entre àtoms, provant les seves reaccions en contacte amb altres substàncies polars o observant com es comporta quan s’exposa a un camp electromagnètic.
Passos
Mètode 1 de 3: Disseny d'una estructura puntual de Lewis
Escriu els símbols dels àtoms de la molècula. Per trobar el símbol de cada àtom, consulteu la taula periòdica. Els símbols químics s'utilitzen per representar àtoms en l'estructura de Lewis punt. Vigileu que no els confongueu.
- Per fer l'estructura d'una molècula d'aigua, per exemple, feu un O i dues H.
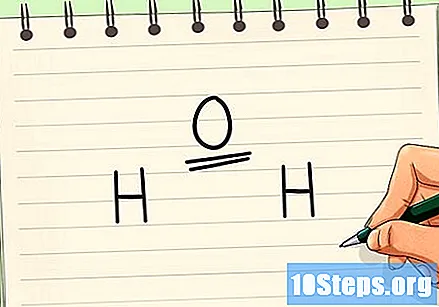
Esbrineu quin és l’àtom central. L’àtom central és el que fa connexions amb tots (o gairebé tots) els altres. També és possible que els altres àtoms es vinculin entre ells. Normalment, l’àtom central té una baixa electronegativitat.- Una excepció a la regla és la molècula d’aigua, que té l’àtom d’oxigen com a central, tot i que és més electronegativa que els àtoms d’hidrogen.
- El diòxid de carboni és un exemple d’una molècula que té l’àtom menys electronegatiu com a central.
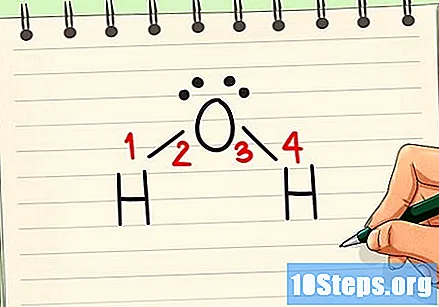
Dibuixa els enllaços químics. Utilitzeu la regla d'octet per saber quants enllaços hi ha a la molècula i quin tipus són. Cada àtom ha de tenir vuit electrons a la closca de valència per mantenir-se estable. Alguns d’ells necessiten fer dues o tres trucades per aconseguir l’estabilitat.- Feu una connexió entre l’oxigen i cadascun dels àtoms d’hidrogen. Els àtoms d'hidrogen no s'uneixen entre ells.

Inclou electrons no vinculants a l'estructura. Tot i que la majoria dels electrons es comparteixen en enllaços químics, alguns àtoms tenen electrons no vinculants. Aquests electrons també s’han d’incloure a l’estructura de Lewis, ja que són extremadament importants per determinar la polaritat d’una molècula. Feu punts al voltant dels àtoms per representar els electrons, lligands o no, de cadascun.- L’oxigen té dos parells d’electrons no vinculants, és a dir, que s’uneixen a l’àtom, sense ser compartits en cap connexió.
Mireu si la molècula té un dipol. Els dipols es produeixen quan la molècula distribueix els electrons de forma. La presència d’un dipol significa que la molècula és polar. Si els electrons es distribueixen uniformement, la molècula no serà polar.
- Com que els electrons són més atrets per l’oxigen que l’hidrogen, acostumen a estar concentrats en aquest costat de la molècula. Això fa que l’oxigen tingui una càrrega negativa i l’hidrogen tingui una càrrega positiva, creant un dipol i convertint l’aigua en una molècula polar.
Mètode 2 de 3: Prova de la substància en dissolvents
Ompliu un vas amb aigua. L’aigua és un dissolvent polar: poseu-ne 100 ml en un vas de vidre net i poseu-lo de banda.
Ompliu un altre vas amb un dissolvent no polar. Alguns exemples de dissolvents nopolars són el toluen, la benzina i els olis en general. Col·loqueu 100 ml d’un dissolvent no polar en un altre vas de vidre i deixeu-ho al costat, juntament amb l’aigua.
- Molts dissolvents no polars són compostos orgànics volàtils (COV) i poden ser força perillosos. Tingueu cura en escalfar-los i utilitzeu guants i una màscara per protegir-vos.
- L’oli vegetal és un dissolvent no volàtil i no volàtil que es pot utilitzar en el segon vas de vidre.
- L’acetona també és un dissolvent orgànic relativament segur. Tanmateix, en tractar-se d’un compost volàtil, s’ha de mantenir allunyat del foc i s’ha de manipular amb guants i una màscara de protecció.
Col·loqueu quantitats iguals de la substància als dos vasos de vidre. Col·loqueu una mica de la substància escollida dins dels dos envasos, tenint cura d’utilitzar quantitats iguals. Comença per afegir de 10 a 20 g de substància a cada vas de precipitats, o de 10 a 20 ml si és líquida.
- Podeu posar 20 ml d'alcohol isopropílic dins de cada vas de vidre, per exemple.
Agiteu i escalfeu les barreges. És possible que hagueu d’escalfar o remenar els dissolvents perquè les substàncies interactuin entre elles. Els dos dissolvents s’han de barrejar i escalfar per igual. Recordeu que escalfar dissolvents orgànics, com el toluen, pot ser perillós. Teniu molta cura d’ells.
- Si utilitzeu alcohol isopropílic, simplement agiteu la solució per activar-lo. No cal escalfar-lo.
- Utilitzeu un plat calent per escalfar lentament les barreges. No poseu dissolvent orgànic al foc.
Deixeu refredar els vasos. Després que les substàncies comencin a interaccionar amb un o amb els dos dissolvents, deixeu que les mescles es refredin. Això farà que les substàncies es separin dels dissolvents si no són compatibles amb ells, a més de facilitar el seu treball.
Observeu els resultats. Mireu si hi ha substàncies líquides o sòlides que es separen del dissolvent. Si és així, vol dir que la substància no és compatible amb aquell dissolvent. Les molècules polars són compatibles amb dissolvents polars i molècules no polars amb dissolvents no polars. Per tant, qualsevol substància que es dissol en l’aigua és polar. Les substàncies que no es dissolen en l'aigua, però són compatibles amb la gasolina, el toluen, l'acetona o qualsevol altre dissolvent no polar, també són no polars.
- Quan les dues barreges estiguin a punt, l’alcohol isopropílic es dissoldrà completament a l’aigua, però formarà una capa d’oli vegetal al segon vas de vidre. Això significa que l’alcohol isopropílic és polar.
Mètode 3 de 3: Prova de les molècules amb electromagnetisme
Col·loca la substància a prop d’un imant. Podeu esbrinar si una substància és polar o no polar acostant-la a un imant o a un objecte amb una gran càrrega magnètica. Suporteu la substància en un banc i apropeu l’imant sense tocar-lo.
Mireu si hi ha alguna reacció. Si l’imant és atret o repel·lit per la substància, vol dir que és polar. Tanmateix, l’absència de reacció no significa que la substància sigui no polar. Algunes molècules polars no estan prou polaritzades per produir reaccions febles en imants.
- Si moveu un imant a prop d’un corrent d’aigua corrent, per exemple, farà que el líquid es desviï, indicant una reacció clara al camp electromagnètic.
Porteu la substància al microones. Els forns de microones fan servir radiacions electromagnètiques d’alta freqüència per girar molècules d’aliments, creant fregament i calor. Per provar la polaritat d’una substància, poseu-la al microones.
- No introduïu mai materials metàl·lics, inflamables o explosius al microones.
- Quan es posa al microones, l’aigua s’escalfa, cosa que vol dir que és polar.
- L’oli mineral, en canvi, no s’escalfa bé quan es porta al microones, cosa que significa que no és polar.
Enceneu el microones. Quan s’exposen a radiacions electromagnètiques, les molècules de la substància començaran a girar. No podreu veure aquest fenomen, però vol dir que la substància és polar. Si no és polar, no patirà cap canvi al microones.
Observeu la substància. Mireu si fa calor i hi ha signes de fusió o deformació. Si s’ha vist afectat per la radiació de microones, vol dir que és polar.