
Content
Altres seccionsL’hidrogen és l’element més lleuger i té molts usos industrials, inclosa la creació de greixos hidrogenats per a la cuina i la producció d’hidrocarburs a partir del carbó. És una part essencial de les molècules d’aigua i es pot separar mitjançant una petita quantitat d’electricitat. També podeu produir hidrogen gasós utilitzant alguns metalls actius i àcids forts. Tots dos mètodes són relativament senzills i us permetran recollir hidrogen gasós.
Passos
Mètode 1 de 2: Ús del desplaçament d’aigua amb metalls actius
Reuneix els materials necessaris. Per recollir l’hidrogen mitjançant la reacció de barrejar un àcid fort amb un metall actiu, necessitareu: un matràs Erlenmeyer, un tap de goma, tubs de plàstic, aigua destil·lada, provetes, un recipient gran, 3 àcids clorhídrics molars (HCl) i pellets de magnesi o de zinc.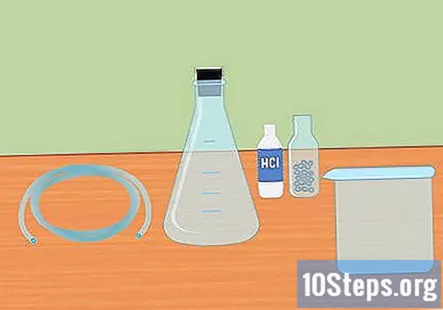
- Un matràs Erlenmeyer és un matràs de vidre que té el fons cònic i el coll cilíndric.
- El tap de goma és per a la part superior del matràs i ha de tenir un forat al mig perquè pugui passar el tub.
- El magnesi o el zinc funcionaran per a aquest experiment, no els necessiteu tots dos.
- És possible que alguns d’aquests subministraments s’hagin de comprar en línia o a una botiga de subministraments de laboratori.

Porteu equip de protecció adequat. Quan treballeu amb un àcid fort com l’àcid clorhídric, voleu assegurar-vos de prendre les precaucions de seguretat adequades. És fonamental portar una bata de laboratori, guants, sabates de punta tancada i protecció dels ulls.- Les ulleres s’han d’embolicar als costats dels ulls per protegir-les de les esquitxades.
- Utilitzeu guants que encaixin correctament per mantenir una bona destresa de les mans i els dits.
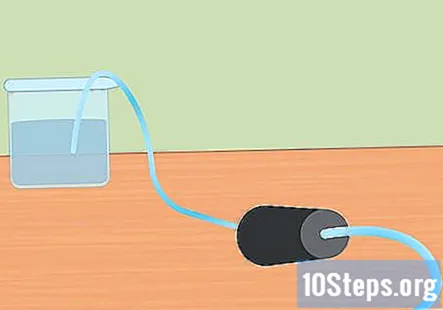
Prepareu la configuració experimental. Introduïu un extrem del tub al forat del tap de goma. Voleu que els tubs passin per tot el tap de goma i que surtin lleugerament des del final. Ompliu el recipient gran amb aigua i col·loqueu l’extrem lliure del tub a l’aigua. Quan comenci l’experiment, posareu el tap de goma al matràs Erlenmeyer.- Deixeu de banda aquestes peces fins que estigueu a punt per utilitzar-les.
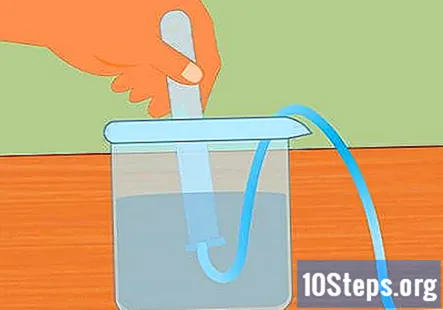
Submergiu la proveta a l’aigua. Agafeu com a mínim una proveta (podeu utilitzar-ne més si voleu recollir més hidrogen) i submergiu-la a l’aigua. Inclineu el tub perquè puguin escapar totes les bombolles d’aire. Col·loqueu el tub a la part superior del tub submergit unit al tap de goma a l’extrem oposat.- És essencial que totes les bombolles d’aire s’eliminin del tub abans de començar. Si no ho són, el gas recollit al tub serà més que hidrogen.
Afegiu àcid clorhídric al matràs Erlenmeyer. Afegiu prou àcid clorhídric per omplir el matràs cap a la meitat. N’hi hauria prou amb uns 100 ml. Assegureu-vos que el matràs estigui net i sec abans d’afegir l’àcid. Utilitzeu guants de goma i tingueu precaució a l’hora d’omplir el matràs.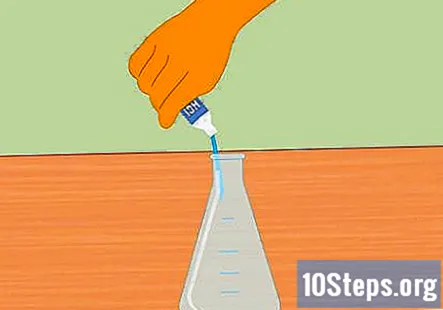
- Tingueu cura de no vessar aigua a l’àcid. L’aigua afegida a l’àcid pot provocar una explosió i lesions.
Comenceu la reacció química afegint pellets metàl·lics a HCl. Afegiu un grapat de pastilles de zinc o magnesi a l’àcid clorhídric del matràs. La quantitat exacta que poseu no és important, però n'hi hauria prou amb un grapat petit per iniciar la reacció.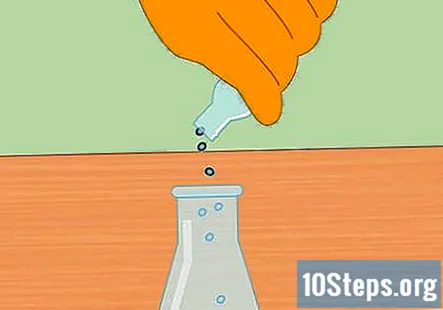
- Després d'afegir els grànuls, col·loqueu el tap al matràs de manera que el sistema estigui tancat.
Recolliu l’hidrogen en una proveta submergida. A mesura que el metall reacciona amb l'àcid, es produeix hidrogen gasós. Aquest hidrogen viatja a la part superior del matràs, a través del tub i cap a la proveta submergida a l'aigua. El gas desplaçarà l’aigua i hauríeu de veure una forma de bombolla a la part superior de la proveta.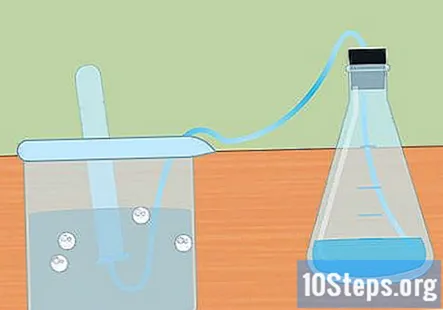
- Quan el tub d’assaig s’ompli d’hidrogen, submergiu un altre tub amb aigua i col·loqueu-lo sobre el tub. Podeu recollir tanta quantitat d’hidrogen com la vostra reacció.
- Mantingueu els tubs d’assaig cap avall per evitar que l’hidrogen gasós s’escapi a l’aire.
Confirmeu que el gas és hidrogen. Per confirmar que el gas és hidrogen, podeu fer el que s'anomena prova de fèrula. Enceneu un llumí i manteniu-lo a sota del tub. Sentireu un "estalvi" o un crit que indica que hi ha hidrogen.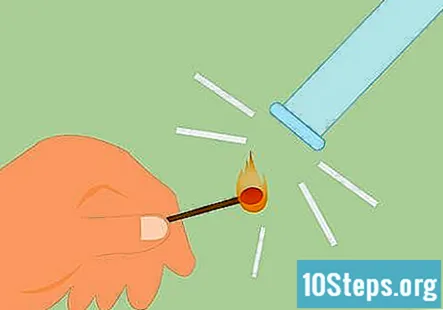
Mètode 2 de 2: utilitzar electròlisi
Reuneix els materials necessaris. En aquest experiment, utilitzarà l’electricitat per separar els gasos d’hidrogen i oxigen de les molècules d’aigua. Per recollir l’hidrogen gasós mitjançant electròlisi, necessitareu una bateria de 9 volts, un llapis, dos tubs d’assaig, un recipient de plàstic, aigua, bicarbonat de sodi, dues grans bandes de goma (opcionals) i un clip de bateria amb pinces al final.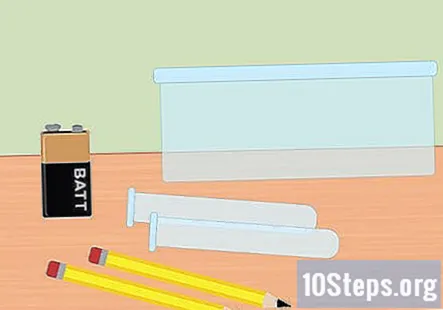
- El llapis ha de tenir grafit perquè funcioni. Un llapis número 2 és perfecte. Per a això també funcionaran dues petites peces de grafit.
- N’hi ha prou amb un petit recipient o recipient per emmagatzemar aliments.
- Assegureu-vos que el clip de la bateria s’adapti a una bateria de 9 volts i que tingui un fil negre i vermell amb pinces de cocodril al final. Aquestes pinces s’utilitzaran per connectar el sistema a la bateria.
Traieu la goma d'esborrar del llapis i trenqueu el llapis per la meitat. Necessiteu dues peces de grafit, una per a l'extrem positiu de la bateria i per a l'extrem negatiu de la bateria. Afineu els dos extrems de cada tros del llapis fins a un punt. Assegureu-vos que el grafit estigui ben exposat.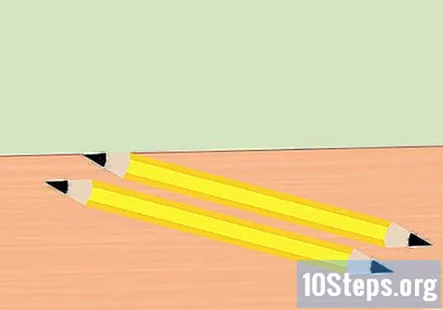
- Aquest pas es pot ometre si ja teniu dues peces de grafit pur.
Emboliqueu 2 gomes al voltant del contenidor en forma de X. Aquest pas és opcional, però és una manera senzilla de mantenir els tubs d’assaig al seu lloc mentre s’executa l’experiment. Estireu una goma sobre el contenidor i estireu una segona goma sobre ella de manera que creui sobre la primera formant una X.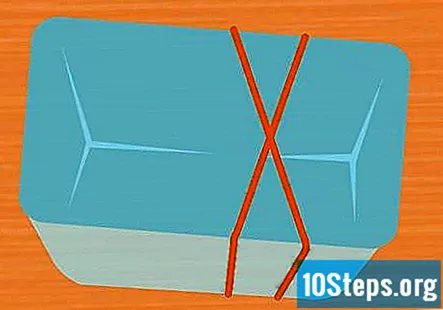
- Si no feu servir gomes, assegureu-vos de fixar els tubs d’assaig amb cinta adhesiva o corda perquè es mantinguin al revés durant l’experiment.
Feu una solució de bicarbonat i aigua. Dissoldre bicarbonat de sodi a l’aigua ajudarà a la conducció de l’electricitat al sistema. La quantitat exacta de bicarbonat de sodi afegit no és important, però n'hi ha prou amb 1 culleradeta per 1 tassa d'aigua. Remeneu fins que es dissolgui completament.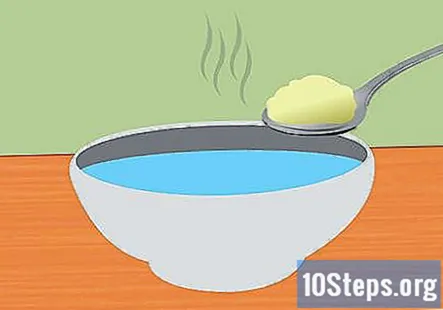
- Utilitzeu aigua tèbia per accelerar la dissolució del bicarbonat de sodi.
Ompliu el recipient de plàstic i els tubs d’assaig amb la solució de bicarbonat. El contenidor ha de ser prou gran per contenir els dos tubs d’assaig. Afegiu prou de la solució per omplir el recipient aproximadament tres quartes parts. Submergiu els tubs d’assaig a la solució del recipient i gireu-los cap per avall. Col·loqueu cada tub a la creu de la goma X per mantenir-lo al seu lloc.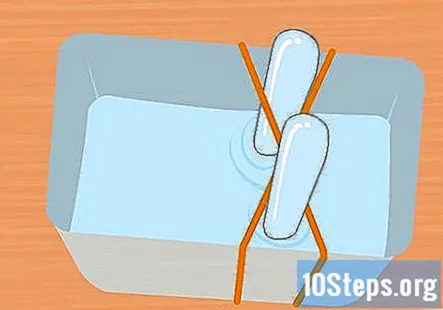
- És molt important que els dos tubs d’assaig estiguin completament plens d’aigua i no quedin bombolles d’aire.
Col·loqueu les pinces de cocodril al grafit. Traieu una pinça del clip de la bateria i fixeu-la a l'extrem d'un dels llapis. Assegureu-vos que toqui el màxim grafit possible. Feu el mateix amb la pinça de caimà i la peça de llapis restants.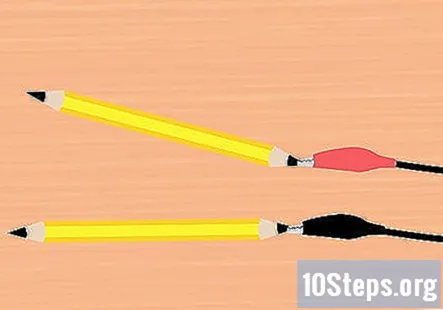
- S’ha d’adjuntar un llapis a la pinça vermella i un llapis a la pinça negra.
Feu lliscar l'extrem no llampat del llapis a la proveta. Mantenint el tub d’assaig completament submergit, inclineu-lo lleugerament per tal que pugueu lliscar l’extrem no llampat del llapis cap al tub. Repetiu aquest procés amb l’altre llapis i l’altra proveta.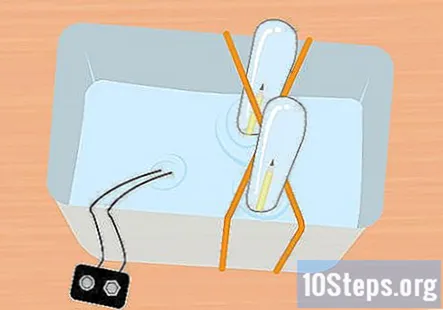
- En aquest punt, tot hauria d’estar sota l’aigua i hi hauria d’haver un tros de llapis dins de cada proveta.
- Mantingueu l’extrem de la pinça de la bateria que s’enganxa a la bateria fora de l’aigua.
Connecteu el clip de la bateria a la bateria de 9 volts. Amb tot preparat, ja esteu a punt per aplicar l’electricitat que proporciona la bateria de 9 volts. L'extrem del clip de la bateria hauria de sortir del contenidor, de manera que només heu de retallar-la al lloc. Un cop connectada la bateria, haureu de notar bombolles que pugen des de l’extrem del grafit i floten fins a la part superior de cada proveta.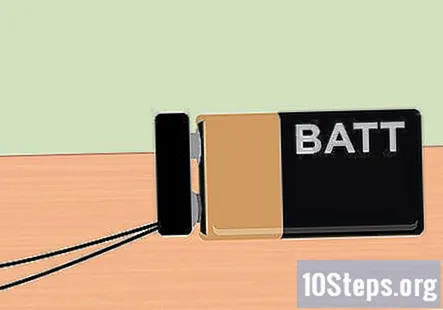
- Si no veieu bombolles produïdes, comproveu que les pinces de caiman estiguin ben fixades al grafit del llapis. A més, comproveu que la bateria estigui completament carregada.
- La proveta amb el fil negatiu unit al llapis produirà hidrogen, mentre que la proveta connectada al fil positiu de la bateria produirà oxigen.
Recolliu hidrogen i oxigen a les dues provetes fins que tingueu uns centímetres de gas a cada tub. Recordeu que el tub connectat a l’extrem negatiu de la bateria tindrà l’hidrogen i l’oxigen estarà al tub connectat a l’extrem positiu. Traieu els tubs d’assaig del pot, un per un. Mantingueu-los al revés i deixeu escórrer l’aigua. El gas dels tubs es mantindrà tot i que no el pugueu veure.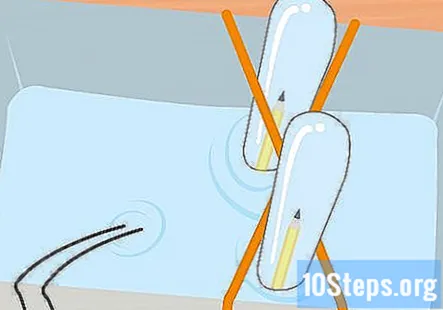
Prova de la presència d'hidrogen. Podeu provar la presència d’hidrogen fent un llumí i mantenint la flama cap al gas. Emetrà un so "pop grinyolant" molt diferent si es tracta d'hidrogen. També podeu utilitzar una espelma encesa en lloc d’un llumí.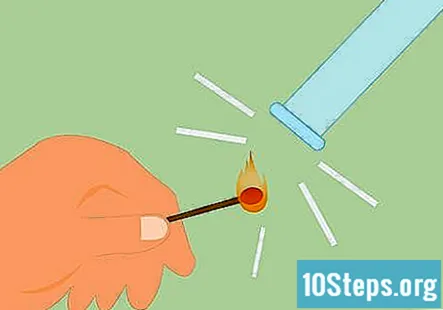
- Per provar l'oxigen al tub d'assaig que estava connectat al costat positiu de la font d'energia, buqueu un llumí encès (o espelma) i col·loqueu l'extrem encara brillant sota el tub d'assaig. Si l’espelma es torna a encendre, l’oxigen és present.
Preguntes i respostes de la comunitat
Necessito dues provetes si només vull recollir hidrogen?

El científic ambiental Bess Ruff és estudiant de Geografia a la Universitat Estatal de Florida. Va rebre el seu màster en ciències i gestió ambiental de la Universitat de Califòrnia, Santa Bàrbara, el 2016. Ha realitzat treballs d’enquesta per a projectes de planificació del territori marí al Carib i ha donat suport a la investigació com a becària del Sustainable Fisheries Group.

Quant d’hidrogen es pot recollir d’aquest senzill experiment d’electròlisi? I quina seria la pressió del gas hidrogen?
Depèn. La velocitat de reacció (divisió d’aigua) es basa en els amplificadors de la bateria i el temps que queda per reaccionar. Normalment, l’hidrogen estaria a una pressió aproximada del nivell del mar, tret que feu l’experiment en un entorn molt calent o fred.
Per què l’hidrogen es recull al tub negatiu
A causa de la forma en què les molècules d’aigua comparteixen electrons, els àtoms d’hidrogen estan carregats positivament i els àtoms d’oxigen estan carregats negativament. En extreure els gasos, l’hidrogen carregat positivament serà atret pel tub negatiu, mentre que l’oxigen carregat negativament serà atret pel tub positiu.
Per què el gas no va escapar del meu tub de recollida de gas?
És l’hidrogen, un gas més lleuger que tots els altres, inclòs l’heli, és a dir, que romandrà a la proveta sempre que l’extrem tancat del tub estigui a la part superior perquè els altres gasos el desplacen. La raó per la qual fem servir heli en lloc d’hidrogen és que no és inflamable. Això es deu al fet que és un gas noble (té una capa de valència completa de 8 electrons) i, per tant, no és reactiu.
El gas seria molt inflamable?
Sí. Vegeu el desastre de Hindenburg a YouTube. Els zepelins utilitzaven hidrogen perquè era el gas més lleuger i bastant fàcil d’obtenir. També és per això que alguns fabricants de cotxes treballen en cotxes que funcionen amb hidrogen.
és aquesta la forma líquida de l’hidrogen?
No, l’hidrogen d’aquest experiment serà gasós
Com liquico l’hidrogen? Resposta
Advertiments
- Aneu amb compte amb l’hidrogen pur. És molt explosiu quan es barreja amb l’aire.
- Assegureu-vos que s’ha eliminat la resta d’aire de l’equip on recol·lecteu hidrogen.


