
Content
El percentatge de massa determina el percentatge de cada element que forma un compost químic. Per trobar aquest valor, necessitareu la massa molar dels elements compostos en grams / mols o el nombre de grams que s’utilitzen per crear la solució. El percentatge de massa es pot calcular d’una manera senzilla mitjançant una fórmula bàsica que divideix la massa de l’element (o solut) per la massa del compost (o solució).
Passos
Mètode 1 de 2: Trobar el percentatge de massa amb les masses donades
- Definiu l’equació del percentatge de massa d’un compost. La fórmula bàsica d’un compost és: massa percentual = () x 100. Heu de multiplicar el resultat per 100 al final per expressar els valors com a percentatges.
- La massa d’un compost químic que us interessa és la massa donada en el problema. Si no es proporciona aquest valor, consulteu el mètode següent i apreneu a trobar el percentatge de massa quan no es dóna la massa.
- La massa total d’un compost es calcula afegint les masses de tots els elements utilitzats per crear el compost o la solució.
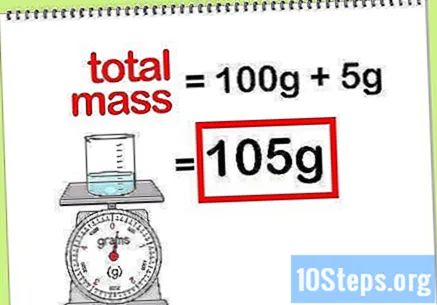
Calculeu la massa total del compost. Quan conegueu el valor de la massa de tots els elements o compostos que s’afegeixen, simplement heu de sumar-los per calcular la massa del compost o la solució final. Aquest valor serà el denominador en el càlcul del percentatge de massa.- Per exemple: Quin és el percentatge de massa de 5 g d’hidròxid de sodi dissolt en 100 g d’aigua?
- La massa total del compost és la quantitat de peròxid de sodi més la quantitat d'aigua: 100 g + 5 g, que totalitzen una massa de 105 g.

Identifiqueu la massa del producte químic en qüestió. Quan necessiteu trobar el fitxer massa percentual, el problema vol que trobeu la massa d'un element específic (l'element en qüestió) com a percentatge de la massa total de tots els elements. Fixeu-vos en la massa de l’element en qüestió. Aquest valor serà el numerador en el càlcul del percentatge de massa.- Per exemple, la massa de l’element és de 5 g d’hidròxid de sodi.
- Substituïu les variables a la fórmula de la massa percentual. Després de determinar els valors de cada variable, substituïu-los a l'equació.
- Per exemple: percentatge de massa = () x 100 = () x 100.

Calculeu el percentatge de massa. Ara que es forma l’equació, només cal resoldre-la per calcular el percentatge de massa. Divideix la massa de l’element per la massa total del compost i multiplica per 100. El resultat serà el percentatge de massa de l’element químic.- Per exemple: () x 100 = 0,04761 x 100 = 4,751%. Així, el percentatge de massa de 5 g d’hidròxid de sodi dissolt en 100 g d’aigua és del 4,751%.
Mètode 2 de 2: Trobar el percentatge de massa amb masses no donades
- Definiu l’equació del percentatge de massa d’un compost. La fórmula bàsica del percentatge de massa d’un compost és: massa percentual = () x 100. Heu de multiplicar el resultat per 100 al final per expressar els valors com a percentatges.
- Quan no coneixeu els valors de la massa, podeu trobar el percentatge de massa d’un element del compost mitjançant la massa molar.
- Per exemple: Quin és el percentatge de massa d’hidrogen en una molècula d’aigua?.
Escriu el fórmula química. Si no es proporcionen les fórmules químiques per a cada compost, haureu d’escriure-les. En cas contrari, aneu al pas "Cerqueu la massa de cada element".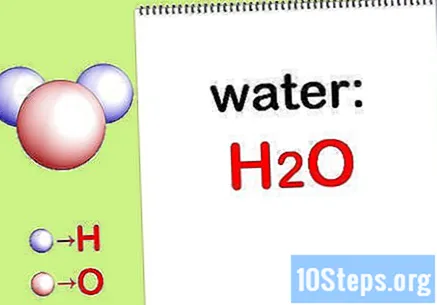
- Per exemple, escriviu la fórmula química de l’aigua: H2EL.
Trobeu la massa de cada element en el compost. Cerqueu el pes molecular de cada element de les fórmules químiques fent referència a la taula periòdica. En general, la massa d’un element es troba a sota del símbol d’element químic. Fixeu-vos en les masses de cada element del compost.
- Per exemple, la massa molecular de l’oxigen és 15,9994 i la de l’hidrogen 1,0079.
Multiplicar les masses per la relació molar. Identifiqueu quants mols de cada element hi ha al compost químic. El nombre de mols ve donat pel nombre subscrit del compost. Multiplicar la massa molecular de cada element per la relació molar.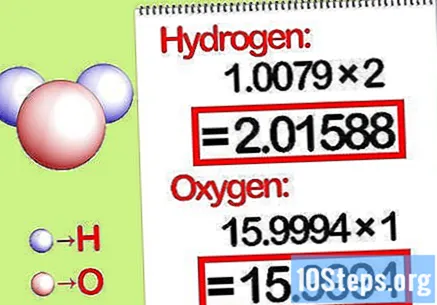
- Per exemple, la proporció molar d’hidrogen a oxigen a l’aigua és de 2: 1. Per tant, multipliqueu el pes molecular de l’hidrogen per dos (1,00794 X 2 = 2,01588) i deixeu el pes molecular de l’oxigen tal com és (15,9994).
Calculeu la massa total del compost. Afegiu la massa total de tots els elements del compost. Utilitzant les masses calculades per la relació molar, és possible calcular la massa total del compost. Aquest nombre serà el denominador de l’equació de massa percentual.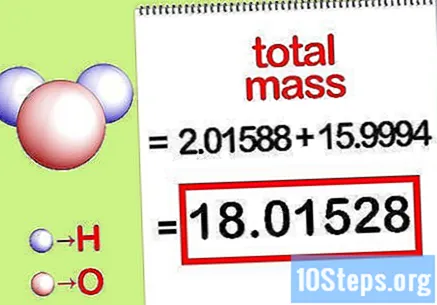
- Per exemple, afegiu 2,01588 g / mol (la massa de dos mols d’àtoms d’hidrogen) amb 15,9994 g / mol (la massa d’un sol mol d’un àtom d’oxigen) i obteniu 18,01528 g / mol.
Identifiqueu la massa de l’element en qüestió. Quan necessiteu trobar el fitxer massa percentual, el problema vol que trobeu la massa d'un element específic en un compost com a percentatge de la massa total de tots els elements. Identifiqueu la massa de l’element en qüestió i escriviu-la. És el valor de la massa calculat mitjançant la relació molar. Aquest valor és el numerador de l'equació de massa percentual.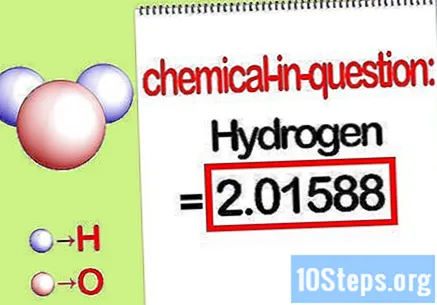
- Per exemple, la massa d’hidrogen del compost és de 2.01588 g / mol (la massa de dos mols d’àtoms d’hidrogen).
- Substituïu les variables per la fórmula de la massa percentual. Després de determinar els valors de cada variable, substituïu-los per l'equació definida al primer pas: massa percentual = () x 100.
- Per exemple: percentatge de massa = () x 100 = () x 100.
Calculeu el percentatge de massa. Ara que es forma l’equació, només cal resoldre-la per calcular el percentatge de massa. Divideix la massa de l’element per la massa total del compost i multiplica per 100. El resultat serà el percentatge de massa de l’element químic.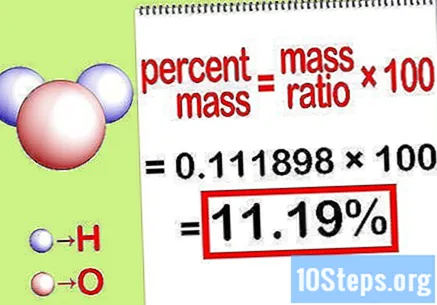
- Per exemple, percentatge de massa = () x 100 = 0,1111189 x 100 = 11,18%. Així, el percentatge de massa d’àtoms d’hidrogen en una molècula d’aigua és de l’11,18%.


